体に優しいω3脂肪酸を動かし肥満を抑える新しい脂質代謝酵素の発見
我々は、脂質を代謝する酵素の生理的役割に関する研究から、白色脂肪組織に常在するM2マクロファージから分泌される脂質分解酵素がω3脂肪酸を作り出し、脂肪の燃焼を促進して肥満の進行を遅らせることを発見した。この成果は、肥満や糖尿病などの生活習慣病の新規予防・治療法の開発につながると期待される。
Sato, H., Taketomi, Y., Miki, Y., Murase, R., Yamamoto, K., Murakami, M.
Secreted phospholipase PLA2G2D contributes to metabolic health by mobilizing omega-3 polyunsaturated fatty acids in white adipose tissue.
Cell Rep., 31, 107579, 2020
AMEDプレス発表はこちら
1 研究の背景
生活習慣の欧米化に伴い、肥満や2型糖尿病などの生活習慣病の増加が社会問題となっている。脂肪組織には、脂肪を蓄える白色脂肪細胞と、脂肪を燃焼する褐色脂肪細胞が存在し、カロリーの貯蔵と消費のバランスを取っている。飽食による糖や脂肪の過剰摂取、運動不足によるエネルギー消費の低下が生活習慣病の背景にあることは疑いの余地がないが、最近では、白色脂肪組織の慢性炎症に加え、褐色脂肪細胞の機能低下による脂肪燃焼の減少が生活習慣病と関連することが注目されている。個体は寒冷にさらされると交感神経の刺激により褐色脂肪細胞が活性化するとともに、白色脂肪組織(特に皮下脂肪)にベージュ脂肪細胞が誘導され、脂肪を分解して熱へと変換する。この適応応答が損なわれると脂肪の燃焼が低下するため、脂肪の蓄積すなわち肥満へとつながる。魚油に豊富に含まれるエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などのω3脂肪酸は、「体によい脂肪」として一般に広く認知されている。ω3脂肪酸は脂肪組織の慢性炎症を抑制するとともに、ω3脂肪酸受容体であるGPR120を介して白色脂肪細胞のベージュ化を促進することで、肥満症を抑える効果があると言われている。また、栄養素として摂取された外因性のω3脂肪酸は細胞膜を構成するリン脂質に取り込まれ、必要時にリン脂質分解酵素ホスホリパーゼA2(PLA2)の作用によりリン脂質から遊離される。しかしながら、脂肪組織においてリン脂質からω3脂肪酸が内因的に動員されるメカニズムとその生理的意義は不明なままであった。
2 研究の概要
今回、本研究グループは、肥満の調節に関わる新たな脂質代謝関連分子を探索する目的で、マウスの白色脂肪組織の遺伝子発現プロファイリング解析を行った結果、肥満に伴い発現が著しく減少する遺伝子として、分泌性PLA2(sPLA2)の一つであるPLA2G2D(sPLA2-IID)を同定した。PLA2G2Dは脂肪組織のM2マクロファージに構成的に発現しており、炎症の進行に伴い発現が低下した。全身性及びマクロファージ特異的PLA2G2D欠損マウスでは、高脂肪食負荷による肥満(図1A)とインスリン抵抗性、さらに脂肪組織の慢性炎症が野生型マウスと比べて増悪していた。また、PLA2G2D欠損マウスは高脂肪食を与える前から酸素消費量(=エネルギー消費量を反映)が野生型マウスと比べて低く、さらに興味深いことに、寒冷曝露時、あるいはβ3アゴニスト投与時(交感神経刺激を模倣)において、白色脂肪細胞のベージュ化が著しく損なわれていた(図1B)。PLA2G2Dはリン脂質分解酵素であることから、PLA2G2D欠損マウスの白色脂肪組織において減少している遊離脂肪酸をリピドミクスにより探索した結果、PLA2G2Dはリン脂質からω3脂肪酸を選択的に遊離していることがわかった。さらに、ω3脂肪酸に富む魚油含有食をPLA2G2D欠損マウスに与えると、白色脂肪細胞のベージュ化の低下及び肥満進行の表現型が消失した。このことから、M2マクロファージから分泌されるPLA2G2Dは白色脂肪組織中にω3脂肪酸を供給し、脂肪細胞のベージュ化を促進することで、肥満の進行を遅らせる役割を持つものと考えられる(図2)。本研究は、ω3脂肪酸の肥満予防効果に新たな学術的理解を与えるとともに、脂肪組織の微小環境においてω3脂肪酸が内因的に動員されるメカニズムの一端を解明したものである。
3 今後の展望
PLA2G2D-ω3脂肪酸経路を賦活化する戦略は、肥満や糖尿病などの生活習慣病の新規予防・治療法の開発につながることが期待される。PLA2G2Dそのものを薬として投与する、PLA2G2Dを抗体あるいは薬剤で安定化させる、PLA2G2Dの発現を増強させるなどの方策が将来の創薬構想として考えられる(図2)。
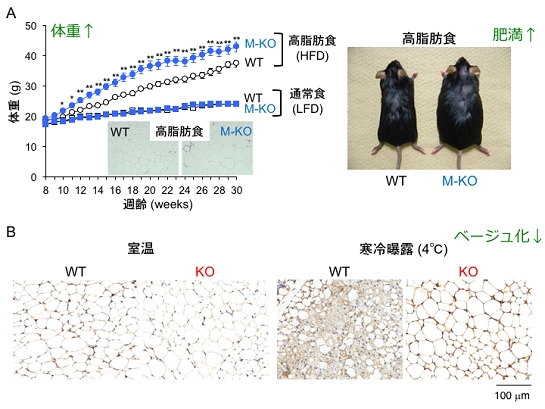
図1. PLA2G2D欠損マウスにおける肥満および脂肪細胞のベージュ化抑制の表現型
(A)マクロファージ特異的PLA2G2D欠損マウス(M-KO)とその対照マウス(WT)に高脂肪食(HFD)または通常食(LFD)を与えた時の体重の経時的変化、脂肪組織の組織像、およびマウスの外観。高脂肪食負荷時においてPLA2G2D欠損マウスでは対照マウスと比べて体重の増加が速くなり、脂肪細胞が肥大化し、肥満が進行する。
(B)PLA2G2D欠損マウス(KO)とその対照マウス(WT)の皮下脂肪組織をUCP1に対する抗体で免疫染色した時の画像。室温ではWT、KOともに大きな単一脂肪滴で満たされた典型的な白色脂肪細胞が見られ、双方に差は認められない。寒冷曝露すると、WTではUCP1陽性(褐色に染色)で小型脂肪滴を豊富に含むベージュ脂肪細胞が出現する。一方、KOではWTと比べて脂肪細胞のベージュ化が抑制されていることがわかる。
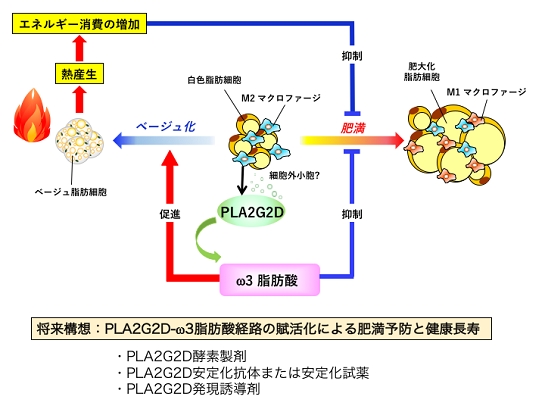
図2. 白色脂肪組織におけるPLA2G2Dによる代謝制御
正常脂肪組織のM2マクロファージに構成的に発現しているPLA2G2Dは、おそらく細胞外微粒子などのリン脂質から選択的にω3脂肪酸を遊離することで、脂肪組織の慢性炎症を抑制するとともに、脂肪細胞のベージュ化を促進して熱産生を増大させ、肥満を防ぐ。

 English
English ホーム
ホーム 研究紹介
研究紹介 研究業績
研究業績 日本語解説
日本語解説 メンバー
メンバー 研究室ドキュメント
研究室ドキュメント コラム
コラム