腸と皮膚の新たなクロストーク:腸内細菌叢を変えて皮膚の健康に影響を及ぼす脂質分解酵素の発見
慶應義塾大学薬学部の有田誠教授、同先端生命科学研究所の曽我朋義教授、医薬基盤健康栄養研究所の國澤純プロジェクトリーダーらとの共同研究により、腸管内腔に分泌されるリン脂質分解酵素の一つであるIIA型分泌性ホスホリパーゼA2(sPLA2-IIA)が、腸内細菌叢のバランスを変えることによって、皮膚がんや乾癬などの皮膚疾患に影響を及ぼすことを発見した。これまで、sPLA2は発現している局所の組織微小環境中において固有の機能を発揮すると考えられてきたが、本研究結果は、sPLA2の一つであるsPLA2-IIAが腸内細菌叢の調節を介して遠隔臓器に二次的変容を導くことを示しており、sPLA2の新しい動作原理を提示するものである。このことから、腸管のsPLA2-IIAを標的とした創薬は、皮膚疾患の新たな診断や治療に役立つ可能性が期待できる。
Yoshimi Miki, Yoshitaka Taketomi, Yuh Kidoguchi, Kei Yamamoto, Kazuaki Muramatsu, Yasumasa Nishito, Jonguk Park, Koji Hosomi, Kenji Mizuguchi, Jun Kunisawa, Tomoyoshi Soga, Eric Boilard, Siddabasave Gowda B. Gowda, Kazutaka Ikeda, Makoto Arita, Makoto Murakami.
Group IIA secreted phospholipase A2 controls skin carcinogenesis and psoriasis by shaping the gut microbiota.
JCI Insight, 7: e152611 (2022).
AMEDプレス発表はこちら(2022/1/26)
東大プレス発表はこちら(2022/1/26)
日本経済新聞記事はこちら(2022/1/26)
マイナビニュース記事はこちら(2022/1/27)
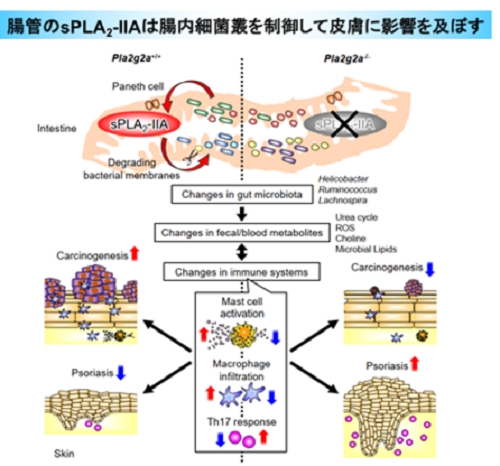
【図:本研究のまとめ】
小腸のパネート細胞から腸管内腔に分泌されるsPLA2-IIAは腸内細菌の膜リン脂質を分解し、腸内細菌叢の調節に関わる。sPLA2-IIAが欠損すると、一部の腸内細菌(Helicobacter, Ruminococcus, Lachnospiraなど)に変容が生じ、糞便や血中の代謝物(尿素回路・活性酸素(ROS)・コリン代謝に関連する代謝物や、細菌固有の脂質など)が変わることで、免疫応答に影響を及ぼす。その結果、sPLA2-IIAノックアウトマウスでは遠隔臓器の皮膚においてがんの進展が軽減する一方で、乾癬が増悪する。詳細は以下参照。
1.研究の背景
最近、腸内細菌叢の変容が宿主の全身の健康状態に大きな影響を及ぼすことが注目されており、ある種の腸内細菌が産生する代謝物は、全身の免疫・代謝・神経系などの調節に深く関わる。これまでに、いくつかの宿主側の因子(その多くは抗菌活性を有するペプチドや腸内免疫の調節に関わる因子)が腸内細菌叢の制御に関わることが報告されているが、その全体像は十分に解明されていない。
sPLA2ファミリーは、細胞外に分泌されるリン脂質分解酵素の一群で、そのうちの一つであるsPLA2-IIAは1980年代後半に発見され、最も古くから研究されているsPLA2分子種である。ヒトにおいて、sPLA2-IIAは炎症時に様々な組織中に発現誘導されることから、これまでにその機能として、発現局所において脂質メディエーターの産生を介して炎症に関わる可能性や、感染細菌の膜リン脂質を分解することで生体防御に関わる可能性などが提唱されてきた。例外的にヒトの腸管には炎症の有無にかかわらずsPLA2-IIAが常に高発現しているが、その生理的意義は不明であった。特定のタンパク質の生体内での機能を調べるためには、その遺伝子を欠損(ノックアウト)したマウスの解析が極めて有用であり、C57BL/6系統のマウスが広く用いられている。しかしながら、C57BL/6系統のマウスはsPLA2-IIA遺伝子に先天的な変異を持ち、sPLA2-IIAを発現していないため、C57BL/6マウスを用いた通常のノックアウト技術は適用できず、sPLA2-IIAの機能を調べることができなかった。そのため、sPLA2-IIAの生体内機能の解析にはsPLA2-IIA過剰発現(トランスジェニック)マウスが利用されてきた。
本研究では、BALB/c系統のマウスが正常のsPLA2-IIA遺伝子を持つ点に着目し、この系統でsPLA2-IIA遺伝子をノックアウトした。多くの組織でsPLA2-IIAの発現が見られるヒトとは異なり、野生型のBALB/cマウスではsPLA2-IIAは腸管(小腸>大腸)にほぼ限局して発現していた(図1A)。こうした組織分布に関する動物間種差はしばしば問題となるが、見方を変えれば、sPLA2-IIAを欠損させたBALB/cマウスは、腸管に恒常的に高発現しているsPLA2-IIAの機能を調べるには絶好の解析ツールといえる。
2.研究内容
我々はこれまでに、sPLA2ファミリーの全ての分子種のノックアウトマウスを網羅的に作製し、表現型の比較解析を進めてきた。その過程で、sPLA2-IIAノックアウトマウスでは皮膚がんができにくい(図1B)一方で、乾癬が悪化しやすいことを見出した。しかしながら、上述のようにBALB/cマウスではsPLA2-IIAは腸管のみに発現しており、皮膚や免疫系を含む、腸管以外の組織では痕跡程度しか検出できないため、なぜ皮膚に表現型が顕在化するのかが謎であった。小腸において、sPLA2-IIAは様々な抗菌ペプチドを分泌するパネート細胞に発現しており、抗生物質の投与によりその発現が大きく低下する。このことから、sPLA2-IIAは腸内細菌成分により発現誘導され、抗菌ペプチドの一つとして腸内細菌の膜リン脂質を分解して腸内細菌叢のバランスを変えることで、二次的に皮膚に影響を及ぼしている可能性を想定した。
実際に、sPLA2-IIAノックアウトマウスと野生型マウスの腸内細菌叢を比較解析すると、ノックアウトマウスでは属レベルで一部の腸内細菌(Helicobacter, Ruminococcus, Lachnospira属など)に明らかな相違が見られた(図2A)。sPLA2-IIAノックアウトマウスと野生型マウスを出生時から同居飼育(co-housing)すると、互いに食糞する結果、両群の腸内細菌叢に違いが見られなくなり(図2B)、野生型マウスとノックアウトマウスの皮膚の表現型の差が消失した(図2C)。また、ノックアウトマウスの小腸では腸管の免疫や上皮バリアに関わる遺伝子群の発現に変化が見られ(図2D)、特に腸内細菌叢の違いを反映して免疫グロブリン(抗体)遺伝子の発現が大きく変化していた(図2E)。
ノックアウトマウスでは野生型マウスと比べて19の血漿成分に有意な変化がみられ、その中には免疫調節やがん化に関わるものも含まれていた(図3A)。糞便中の脂質を網羅的に分析した結果、ノックアウトマウスでは宿主ではなく腸内細菌に固有に存在する脂質成分が有意に減少していた(図3B)。さらに、よりクリーンな飼育環境で飼育すると、野生型マウスの腸管においてHelicobacterやRuminococcusなどの腸内細菌が減少し、その結果sPLA2-IIAの発現量が低下することで、野生型マウスとノックアウトマウスの間で腸内細菌叢に違いが見られなくなり、それと同時に皮膚の病態に差が認められなくなった。
以上の結果から、小腸パネート細胞から分泌されるsPLA2-IIAは腸内細菌叢の調節に関わり、この経路が遮断されると腸内細菌叢に変容が生じ、二次的に遠隔の皮膚に表現型が顕在化すると結論づけた(図:本研究のまとめ)。
3.本研究の意義・今後の予定
本研究は、長年不明であったsPLA2-IIAの腸管における機能を初めて明らかにしたものである。腸管にはsPLA2-IIA以外のsPLA2分子種も発現していることから、これらも同様に腸内細菌叢の制御を介して遠隔臓器に影響を及ぼしている可能性があり、今後はこれを証明し、理論を一般化することが必要である。上述のように、ヒトとマウスではsPLA2-IIAの発現分布に違いがあるが、腸管に高発現している点については共通していることから、ヒトにおいても腸管のsPLA2-IIAは腸内細菌叢の調節に関わっていることが予想される。このことから、腸管のsPLA2-IIAを標的とした創薬は、皮膚疾患の新たな診断や治療に役立つ可能性が期待できる。
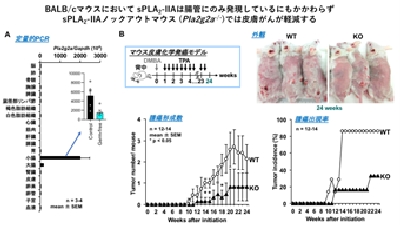
【図1】
(A) BALB/cマウスにおけるsPLA2-IIA (Pla2g2a) の発現分布。Pla2g2aは腸管(小腸>大腸)に限局して発現している。無菌環境で飼育した無菌(Germ-free)マウスではPla2g2aの発現が低下する(Inset)。
(B) 皮膚化学発がんモデルにおいて、sPLA2-IIAノックアウトマウス(KO)では野生型マウス(WT)と比べて皮膚がんの形成率及び出現率が低減する。
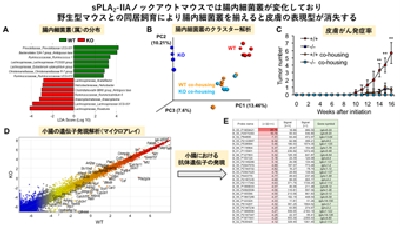
【図2】
(A, B) 腸内細菌叢の解析。野生型マウス(Pla2g2a+/+; WT)とsPLA2-IIAノックアウトマウス(Pla2g2a-/-; KO)では腸内細菌叢に明らかな相違があるが、出生直後から同居飼育(co-housing)すると違いが見られなくなる。
(C) 皮膚がんモデルにおいて、別居飼育した野生型マウスはノックアウトマウスと比べて腫瘍数が多いが、同居飼育群では皮膚がんの発症が低下し、欠損マウスのレベルに近づく。
(D) 野生型マウスとsPLA2-IIAノックアウトマウスの小腸における遺伝子発現の網羅的プロファイリング。対角線から外れている遺伝子がsPLA2-IIA欠損の影響を受けており、この中には免疫や代謝に関わる遺伝子が多く含まれる。(E) 腸内細菌叢の違いを反映して、sPLA2-IIAノックアウトマウスの小腸では野生型マウスと比べて免疫グロブリン(抗体)遺伝子の多くが発現増加している(赤色で表示)。

【図3】
代謝物の解析。sPLA2-IIAノックアウトマウス(Pla2g2a-/-)と野生型マウス(Pla2g2a+/+)を比較すると、血中の水溶性代謝物(A)や糞便中の脂溶性代謝物(脂質)(B)に違いが見られる。欠損マウスの血中で減少している水溶性代謝物は、尿素回路・活性酸素(ROS)・コリン代謝に関連する代謝物や、腸内細菌固有の代謝物などであり、このうちのいくつかはがんとの関連が報告されている(A)。糞便脂質の中では、腸内細菌由来のリノール酸代謝物(CLA1/3, KetoB, KetoCなど)や分岐脂肪酸(AAHFA, FAHFA)が、ノックアウトマウスにおいて有意に減少する(B)。

 English
English ホーム
ホーム 研究紹介
研究紹介 研究業績
研究業績 日本語解説
日本語解説 メンバー
メンバー 研究室ドキュメント
研究室ドキュメント コラム
コラム