リンパ腫における新規発がんメカニズムを発見~脂質を軸とした新たな治療法の開発に期待~
東海大学医学部の幸谷愛教授および東海大学大学院医学研究科の工藤海大学院生らとの共同研究により、リンパ腫の発生や悪性化における細胞外小胞(EV)の新規作動メカニズムを発見した。
Kai Kudo, Yoshimi Miki, Joaquim Carreras, Shunya Nakayama, Yasushi Nakamoto, Masatoshi Ito, Etsuko Nagashima, Kei Yamamoto, Hiroshi Higuchi, Shin-Ya Morita, Asuka Inoue, Junken Aoki, Kiyoshi Ando, Naoya Nakamura, Makoto Murakami, Ai Kotani.
Secreted phospholipase A2 modifies extracellular vesicles and accelerates B cell lymphoma.
Cell Metab., 34, 615-633.e8 (2022).
JSTプレス発表はこちら(2022/03/16)
東海大学プレス発表はこちら(2022/03/15)
東海大学特集ページはこちら(2022/04/25)
東大プレス発表はこちら(2022/03/15)
日経バイオテク記事はこちら(2022/03/17)
医療NEWS記事はこちら(2022/03/18)
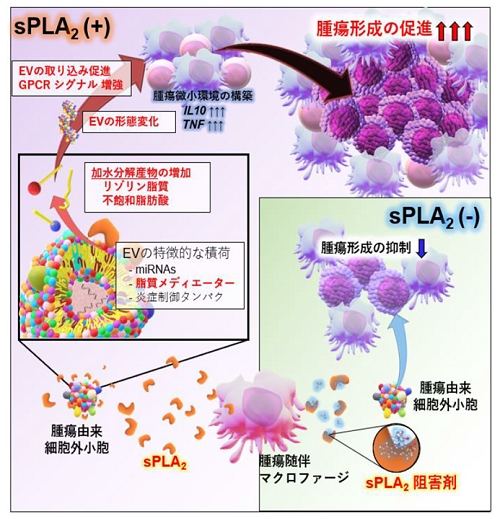
【図:本研究のまとめ】
本研究成果から明らかとなった悪性リンパ腫におけるsPLA2-EV軸を中心とした腫瘍形成メカニズム。
東海大学幸谷グループでは、これまでにEpstein-Barrウイルス(EBV)陽性B細胞性悪性リンパ腫の発症におけるEVの役割を調査してきたが、その作動メカニズムの全容は明らかになっていなかった。一方、我々は、これまでに細胞外環境に存在するリン脂質分解酵素「分泌型ホスホリパーゼA2(sPLA2))」が関与する数多くの生命現象を明らかにしてきたが、実際にsPLA2が細胞外で基質としているリン脂質の供給源は不明だった。
本研究では、悪性リンパ腫組織中の腫瘍随伴マクロファージ(TAM)から分泌されるsPLA2が腫瘍細胞由来EVのリン脂質を分解することを証明し、この分解により「細胞への取り込まれやすさ」や「免疫抑制効果」などのEVの機能が飛躍的に向上し、さまざまな生命現象が誘導されることが分かった。そしてこの時、EVリン脂質の分解産物であるリゾリン脂質などが細胞にシグナルを伝達しているという、これまでのEV生物学にはない新規作動メカニズムを介することを発見した。さらに、ヒトにおけるリンパ腫発生を再現したモデルマウスを使って、sPLA2によるEV分解が腫瘍形成において必要不可欠であることを証明した。また、実際のヒト患者検体の解析からも、sPLA2が腫瘍形成と悪性化に関わることを示した。
一方、本研究ではリンパ腫由来EVのみならず他のがん細胞由来EVもsPLA2により分解されることを証明し、sPLA2-EV軸は腫瘍形成において、共通の現象であることを明らかにした。今後はこのsPLA2-EV軸が新たな「免疫チェックポイント」として、がん治療のための新しい薬物標的となることが期待される。また、本研究で証明されたsPLA2によるEV機能の増強効果から、「組織保護・抗炎症作用を持つEV」などのさまざまな種類のEVが持つ固有の能力をsPLA2が増強するのではないかという、これまでに幸谷グループで報告した仮説の検証も現在行っており、今後は治療的応用への発展も期待される。

 English
English ホーム
ホーム 研究紹介
研究紹介 研究業績
研究業績 日本語解説
日本語解説 メンバー
メンバー 研究室ドキュメント
研究室ドキュメント コラム
コラム