網膜の脂質代謝異常が網膜色素変性症を引き起こすことを発見
本研究では東京大学大学院医学系研究科眼科学教室の相原一教授との共同研究により、網膜における脂質代謝異常が網膜色素変性症を起こすことを明らかにしました。
Takashi Ono, Yoshitaka Taketomi, Takayoshi Higashi, Hiroyasu Sato, Takashi Ueta, Takashi Miyai, Suzumi Tokuoka, Yoshiya Oda, Yasumasa Nishito, Tomio Ono, Choji Taya, Satoru Arata, Sumiko Watanabe, Tomoyoshi Soga, Tetsuya Hirabayashi, Makoto Aihara, Chika Mochizuki-Ono, Yuki Nagasaki, Makoto Murakami*
PNPLA6 regulates retinal homeostasis by choline through phospholipid turnover
Nature Communications. 2025
東大プレス発表はこちら (2025/03/13)
日経新聞プレス発表はこちら (2025/03/13)
発表のポイント
◆脂質は細胞を構成する大事な要素ですが、眼の奥の網膜においてどのような脂質代謝が起きていて、病気に関与しているかについての理解はこれまで不十分でした。
◆リン脂質を分解する脂質代謝酵素の一つであるPNPLA6 は、網膜色素上皮細胞において、ホスホリパーゼB 活性によりグリセロリン脂質を分解して、細胞膜からのコリンの取り出しとその再利用(リサイクル)に関わっていました。
◆このコリンは作り出された網膜色素上皮細胞の増殖や機能に重要であるだけでなく、隣接する視細胞へと受け渡されて、視細胞でも利用されることが分かりました。
◆この脂質代謝経路が障害されると、網膜は変性し、光に対する反応が低下します。
◆PNPLA6 欠損により生じる網膜変性は、コリンの点眼によって進行が妨げられることから、本経路を標的とした創薬は網膜変性疾患の予防治療法の開発につながることが期待されます。
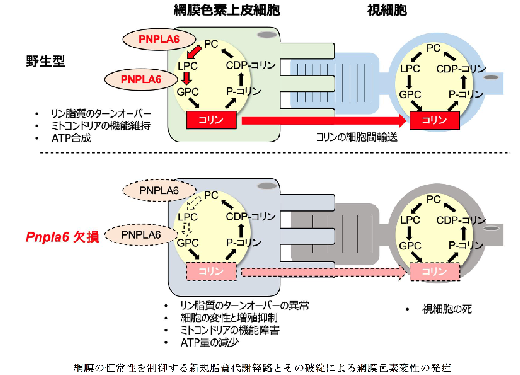
1)研究の背景
難病指定されている網膜色素変性症は進行性で、暗いところで見えにくくなったり、視野が狭くなったりと、徐々に視力が失われていきます。遺伝性の網脈絡膜疾患の中でも最も多く、残念ながら、まだ効果的な治療法は十分に見つかっていません。網膜色素変性症は、光を感知する視細胞と、その視細胞を支える網膜色素上皮細胞の両方がうまく機能しなくなることで起こります。100 種類以上の遺伝子がこの病気に関わっていることが分かっていますが、一体何が原因で視細胞や網膜色素上皮細胞がだめになってしまうのか、そのメカニズムは良く理解されていませんでした。
私たちの体の中には様々な種類の脂質が存在し、これらの脂質が作られたり分解されたりする一連の反応(リサイクル)を介して、体の中で重要な役割を果たしています。私たちは、脂質代謝酵素の中でも、グロセロリン脂質(以下リン脂質)を分解して脂肪酸とリゾリン脂質を生成する「ホスホリパーゼA2(PLA2)」という分子群を中心に解析を進めており、その中でも本研究では特にPNPLA6 という酵素に注目しました。PNPLA6 遺伝子の異常は、網膜色素変性症だけでなく、神経障害や運動失調などを伴う様々な遺伝性疾患で見つかっています。これらの疾患はまとめて「PNPLA6 関連疾患」と呼ばれています。これまでのマウスを使った実験では、PNPLA6 が全くないと胎児のうちに死んでしまうこと、また、神経細胞でPNPLA6 が不足すると神経変性が起こることが分かっています。つまり、PNPLA6 は生命維持に不可欠な脂質代謝を担っていると考えられます。しかし、PNPLA6 が網膜において具体的にどのような脂質を分解し、それがどのように細胞の働きを調節しているのか、詳しいことは分かっていませんでした。
2)研究内容
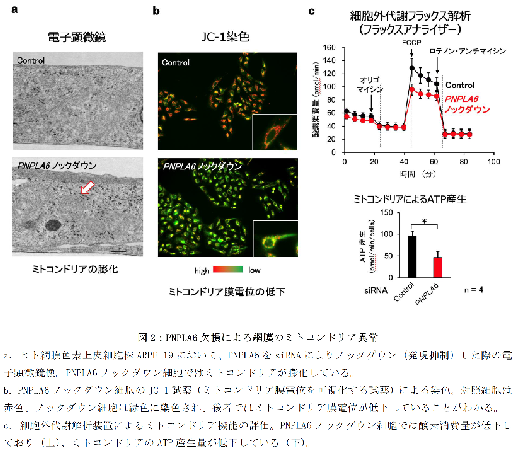
まず、PNPLA6 がヒトおよびマウスの網膜色素上皮細胞において高く発現していることを明らかにしました。さらに質量分析を利用した脂質の網羅解析(リピドミクス)を通じて、PNPLA6 がホスホリパーゼBとしての活性を持ち、細胞膜の主成分であるリン脂質のうち最も豊富なホスファチジルコリン(PC)から2 つの脂肪酸を順次切り出し、リゾリン脂質を経てグリセロホスホコリン(GPC)を生成することが明らかになりました。ヒト網膜色素上皮細胞株においてPNPLA6 を人為的にノックダウン(発現抑制)すると、細胞内のGPC とその代謝物であるコリンの濃度が低下し(図1)、ミトコンドリアに異常が生じました(図2)。また、ミトコンドリアの機能と関連する代謝物やエネルギー(ATP)の産生も減少し、細胞の増殖や接着に異常が見られました。これらの異常は、培地にコリンを補充することで改善されました。さらに、コリンからPC を新たに合成するケネディ経路の関連分子をノックダウンしたところ、PNPLA6 ノックダウンと同様の細胞増殖の異常が確認されました。このことから、PNPLA6 がPC の新陳代謝(古いリン脂質から新しいリン脂質へのリサイクル)に深く関わっていることが示唆されました。また、網膜色素上皮細胞はPNPLA6 に依存してコリンを細胞外に放出しており、PNPLA6 をノックダウンした細胞の上清を用いて視細胞を培養すると、増殖が抑制され、細胞死が見られました。この培地にコリンを補充すると、細胞増殖が回復し、細胞死が抑えられました。これは、PNPLA6 が網膜色素上皮細胞から視細胞へのコリンの供給に重要であることを示しています。
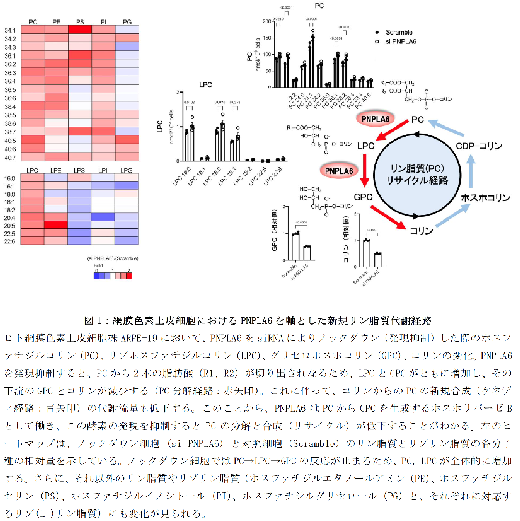
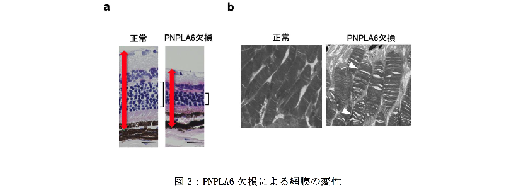
さらに、PNPLA6 コンディショナル欠損マウスにタモキシフェンを点眼することで、眼全体でこの酵素を欠損させると、網膜の菲薄化やミトコンドリアの異常、視細胞の構造変性が確認され、光に対する反応が低下しました(図3)。しかし、コリンを点眼補充すると、これらの網膜変性が正常化されました(図4)。網膜色素上皮特異的にPNPLA6 を欠損させたマウスでも同様の結果が得られました。
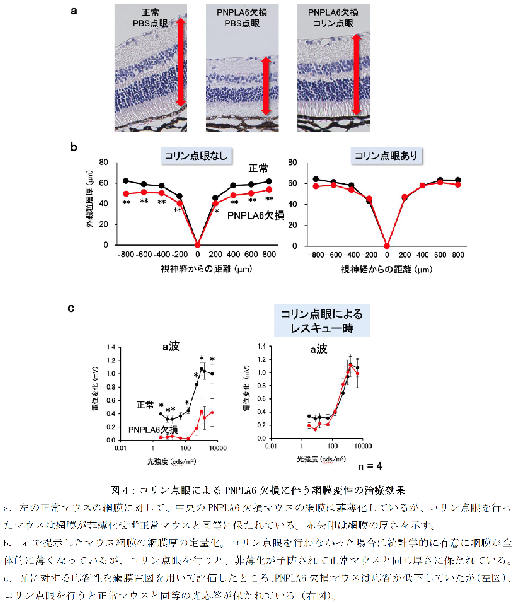
この研究は、PNPLA6 が網膜色素上皮細胞においてPC からGPC を生成し、コリンの動員を通じてPC の新陳代謝を促進することで本細胞の恒常性を保つとともに、隣接する視細胞へのコリン供給を通じて視細胞の健康を維持する役割を果たしていることを示しています。この発見は、網膜疾患の新たな治療法の開発に繋がる可能性を秘めています。
3)本成果の意義・今後の展開
本研究は、研究チームが独自に開発した網膜特異的PNPLA6 欠損マウスを用いることで、脂質代謝酵素PNPLA6 が関与するリン脂質リサイクル経路が、どのようにして網膜の健康を維持し、その破綻が網膜色素変性症を引き起こすのかを明らかにしました。この研究の着眼点は、PNPLA6によるリン脂質(PC)分解の下流で動員されるコリンの新陳代謝の重要性を明らかにした点にあります。網膜に異常のある患者の中に、PC の新規合成(ケネディ経路)に関連するPCYT1Aや、リン脂質の脂肪酸の入れ替え(ランズ回路)に関わるLPCAT1 の変異が確認されており、リン脂質の新陳代謝は網膜の恒常性維持に重要であると考えられます。哺乳動物におけるホスホリパーゼB の生理的役割については、小腸の消化酵素としての役割以外はこれまでに報告がなく、PNPLA6 がPC の新陳代謝を調節するホスホリパーゼB として網膜色素変性症の発症に関与することを示したことは、生化学的にも重要な意義を持ちます。
本研究の結果から、コリン補充法が網膜色素変性症の予防や治療に応用できる可能性や、血液や涙液中のコリン濃度が網膜変性の進行を示す指標となる可能性もあり、網膜色素変性症に対する新しい治療法の開発を通じて、社会的にも大きな貢献を果たすことが期待されます。

 English
English ホーム
ホーム 研究紹介
研究紹介 研究業績
研究業績 日本語解説
日本語解説 メンバー
メンバー 研究室ドキュメント
研究室ドキュメント コラム
コラム